2022年11月17日

帕金森病( Parkinson' s disease, PD) 是继阿尔兹海默病之后第二常见的神经退行性疾病,也是老年人最常见的运动障碍性疾病。其运动症状表现为静止时震颤、肌强直、运动迟缓、姿势步态障碍等,晚期会导致患者生活不能自理。根据Global Health Data统计,全球目前约有850万帕金森病患者,中国现有约250万PD患者,预计到2030年,我国将有约500万PD患者。庞大的PD患病人群给经济和社会带来了沉重的负担,并且随着人口老龄化,PD带来的影响也将随之扩大。世界卫生组织预测,到2040年,PD和其它神经退行性疾病一起,将超过癌症,成为人类第二大致死疾病。目前为止,所有对帕金森病的治疗都只能改善症状,缺乏有效的治愈或延缓疾病发展的措施,因此吸引了大量的临床和基础研究。
PD以大脑黑质致密部多巴胺能神经元退行性病变以及路易小体的形成为主要病理特征,其病因和发病机制仍不清楚。α-突触核蛋白(α-synuclein, α-syn)作为路易小体的主要组分,其错误折叠及异常聚集可导致路易小体的形成、引发神经元毒性,是PD研究的热点。近来研究显示a-syn在神经元细胞之间的传递对PD的发生发展起关键作用,阻碍其传播有望成为新的治疗手段,但a-syn传播的分子机制尚未明确。近期,西交利物浦大学慧湖药学院张曦课题组在Molecular Neurobioloy正式刊出题为SNARE Proteins Mediate α-Synuclein Secretion via Multiple Vesicular Pathways的研究论文。该研究聚焦a-syn细胞间传递的第一步-囊泡分泌,通过研究α-syn分泌的调控机制,SNARE复合体亚型和囊泡定位来阐述α-syn分泌的分子机制。
首先,我们在分化的人神经母细胞瘤细胞SH-SY5Y中确认α-syn释放的钙依赖性,表明α-syn主要由囊泡分泌途径释放到胞外(图1)。并且,我们发现α-syn是通过非经典途径分泌的,受到自噬-溶酶体途径的调控。
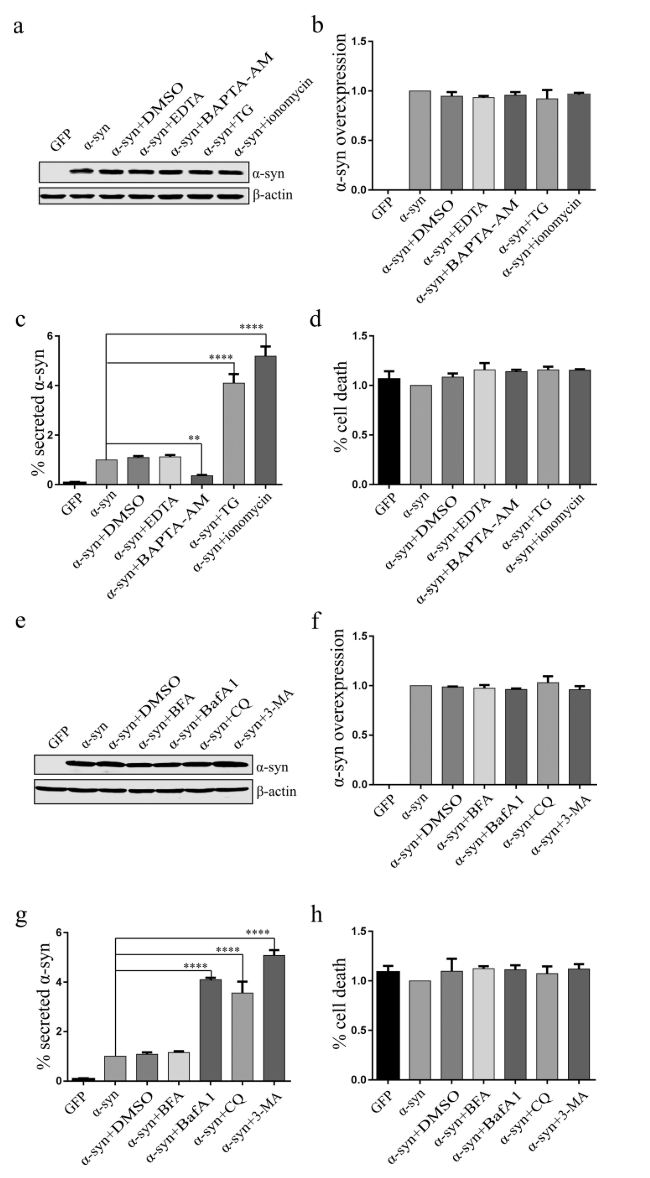
(图1. 分化的SH-SY5Y细胞中钙依赖性的α-syn的分泌受自噬-溶酶体途径调节。)
囊泡的融合需要SNARE复合体,而不同类型的囊泡与质膜的融合是由不同的SNARE复合物亚型介导的。因此,我们可以通过研究α-syn分泌所需要的SNARE复合物亚型来明确其囊泡类型。通过基因敲低的方法,我们发现SNAP23/STX4及与之配对的 VAMP3、VAMP7和VAMP8均参与α-syn胞吐,提示包括循环内泌体、多囊泡体、自噬体和溶酶体在内的多种囊泡介导α-syn的分泌(图2)。
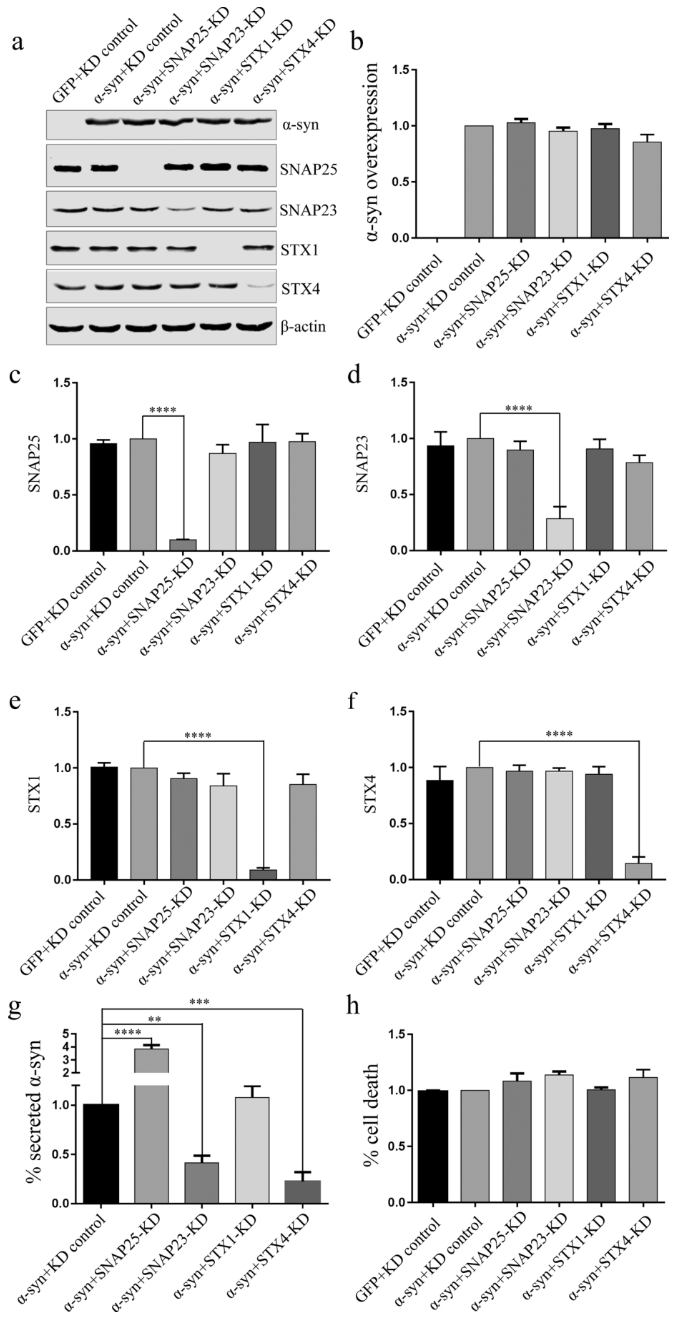
(图2. SNAP23和STX4介导分化的SH-SY5Y细胞分泌α-SYN)
为了验证以上这些囊泡途径参与了α-syn的分泌我们使用超高分辨荧光显微镜来研究α-syn的囊泡定位。结果显示α-syn存在于不同囊泡类型中,并且与自噬体的共定位水平最高(图3)。
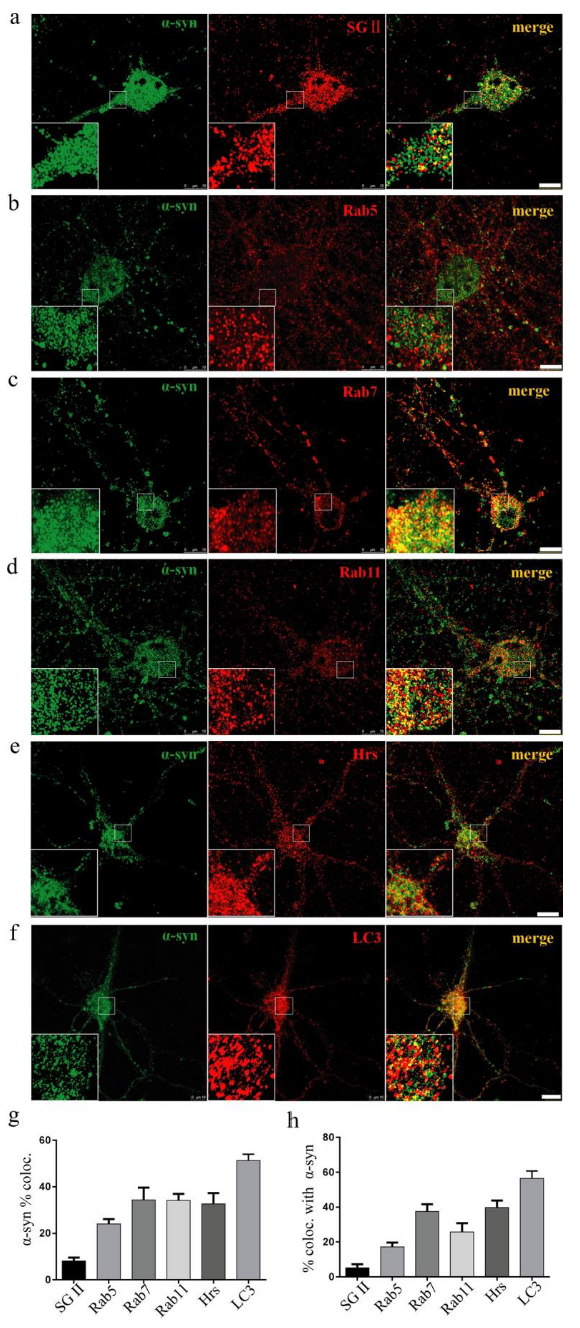
(图3. α-syn在大鼠原代皮层神经元中的囊泡定位)
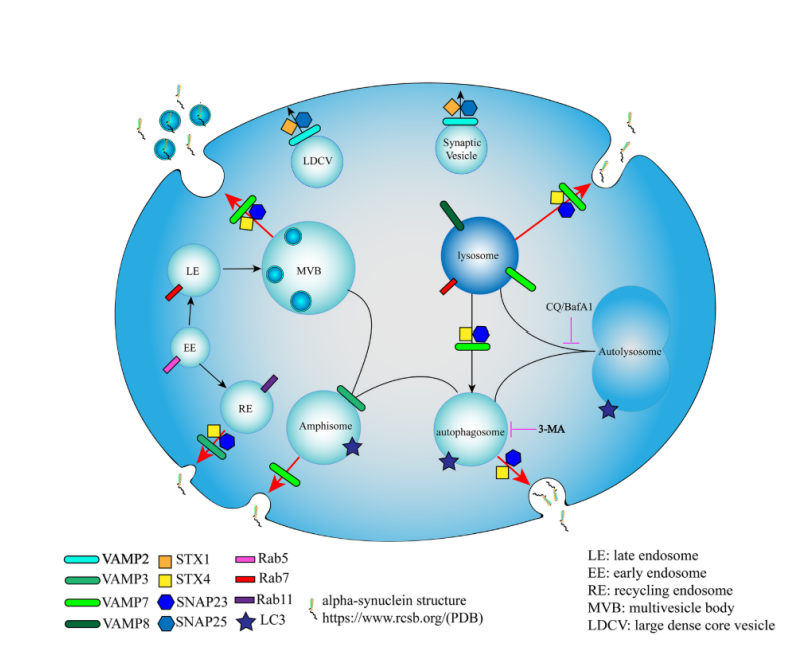
(图4. 多种囊泡介导α-syn分泌。红色箭头标注本研究提出的α-syn分泌途径。)
综上,α-syn通过依赖于Ca2+和SNARE复合物的非经典胞吐途径分泌,循环内泌体、多囊泡体、溶酶体和自噬体等多种囊泡参与其中。本研究阐述了α-syn的囊泡分泌机制,为理解PD的发生发展和新药的研发提供新的思路。
供稿:陆晓旭 张曦
2022年11月17日








